О.Г. Шадрин, Г.А. Гайдучик
ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины», г. Киев, Украина
SOVREMENNAYA PEDIATRIYA.2016.1(73):111-115
Цель:
Исследование жирно-кислотного спектра липидной фракции крови у детей раннего возраста с пищевой аллергией (ПА) и эффективности диетической коррекции его нарушений.
Пациенты и методы. Обследовано 45 детей в возрасте от 6-ти месяцев до 3-х лет. Всем детям проводилось исследование жирно-кислотного спектра липидной фракции крови. Дети из ПА (25 человек) в составе комплексной терапии получали Смарт Омега беби в течение месяца.
Результаты. По результатам анализа жирно-кислотного спектра липидной фракции цельной крови у детей раннего возраста с ПА установлен дисбаланс жирных кислот за счет увеличения доли омега-6 ПНЖК, что свидетельствует о провоспалительной направленности обмена липидов. Включение в состав комплексной терапии ПА Смарт Омега® беби привело к положительным изменениям соотношения омега-3/омега-6 ПНЖК. У пациентов основной группы наблюдения произошло уменьшение расстройств со стороны желудочно-кишечного тракта, улучшение состояния кожи.
Выводы. Учитывая выявленные нарушения соотношения омега-3/омега-6 ПНЖК как у детей с ПА, так и у практически здоровых, прием омега 3 ПНЖК является обоснованным.
Ключевые слова: пищевая аллергия, полиненасыщенные жирные кислоты, дети раннего возраста.
Введение
Распространенность аллергических заболеваний во всем мире приобретает катастрофические масштабы, причем как в развитых, так и в развивающихся странах. Каждые 10 лет количество людей, имеющих аллергические реакции, удваивается. Крайне серьезна проблема аллергии в детском возрасте — за последние 20 лет ее распространенность у детей раннего возраста выросла до 6–10%.
Одной из причин роста аллергических заболеваний является изменение образа жизни и питания населения индустриально развитых стран, особенно крупных городов. Питание современного человека характеризуется дисбалансом между потреблением продуктов, содержащих «чистые» калории наполнителей, солода, пальмового масла и других жиров, и дефицитом в пище витаминов, эссенциальных минеральных веществ, природных жиров, антиоксидантов, незаменимых аминокислот.
В продуктах питания появились компоненты, в частности трансжирные кислоты, заменители сахара, улучшители запаха, вкуса, цвета, консистенции, которых человек раньше не знал, и ферментные системы организма не адаптированы к этим веществам. Изменился не только состав, но качество пищевых продуктов. Увеличение количества таких пищевых продуктов, как сладости и продуктов с высоким содержанием насыщенных жиров приводит к росту эндокринных заболеваний — диабета и ожирения, снижению защитных свойств иммунной системы. С другой стороны, значительное уменьшение в рационе продуктов, обогащенных антиоксидантами и жирными кислотами омега-3, является причиной изменения иммунологического ответа, активизации систем, участвующих в развитии аллергических и аутоиммунных заболеваний [8,9].
Полиненасыщенные жирные кислоты (ПНЖК) относятся к числу незаменимых факторов питания и являются предметом изучения отечественных и зарубежных исследователей. За последние десятилетия накоплен большой объем научных данных, указывающих на важную роль этих соединений в реализации многочисленных физиологических и биохимических процессов в организме как в норме, так и при патологических состояниях, в частности в формировании иммунного статуса, воспалительных реакциях, регуляции системы гемостаза, поддержании тонуса сосудов и гладких мышц, процессов роста, когнитивных функций [3,4,6,7,11]. Вместе с тем установлено, что при метаболизме длинноцепочечных ПНЖК в организме образуются липидные медиаторы аллергии – простагландины, лейкотриены, тромбоксаны и др., причем из разных видов ПНЖК образуются разные классы липидных медиаторов, отличающиеся своей активностью.
Так, метаболиты омега-6 ЖК – лейкотриены 4 серии обладают провоспалительными свойствами, а метаболиты омега-3 ПНЖК – лейкотриены 5 серии, наоборот, проявляют выраженные противовоспалительные характеристики. В связи с этим ПНЖК рассматривают как мощный алиментарный фактор, способный существенно влиять на регуляцию метаболических процессов в организме. Изучению возможных профилактических и лечебных эффектов омега-3 ПНЖК посвящено несколько исследованиий у взрослых, показывающих, что важную роль в развитии аллергических реакций играет уменьшение содержания в сыворотке крови омега-3 ПНЖК и увеличение соотношения ПНЖК омега-6/омега-3, что поддерживает хроническое аллергическое воспаление [5,10,12].
Ключевым представителем омега-6 ПНЖК является арахидоновая кислота (АК), входящая в состав фосфолипидов клеточных мембран тромбоцитов и эндотелиальных клеток. Свободная АК быстро метаболизируется, превращаясь в простагландины и тромбоксаны. Метаболизм АК происходит двумя основными путями – циклооксигеназным и липооксигеназным. Циклооксигеназный путь метаболизма АК приводит к образованию простагландинов и тромбоксана А2, липооксигеназный – к образованию лейкотриенов. Арахидоновая кислота частично попадает с пищей (растительные масла), частично синтезируется в организме, что обеспечивает ее постоянное присутствие. При достаточном поступлении в организм омега-3 ПНЖК вытесняют АК и вступают в конкурентное замещение АК в фосфолипидах клеточных мембран в циклооксигеназном и липооксигеназном путях метаболизма, то есть синтезе эйкозаноидов из омега-6 ПНЖК и омега-3 ПНЖК. Функциональные свойства эйкозаноидов, синтезируемых из омега-6 ПНЖК и омега-3 ПНЖК, в значительной степени противоположны.
Конкуренция между АК и омега-3 ПНЖК на циклооксигеназно-липооксигеназном уровне проявляется модификацией спектра простагландинов и лейкотриенов.
В последние 150 лет мы наблюдаем беспрецедентные изменения в потреблении полезных жиров. Рафинированные масла (кукурузное, соевое, подсолнечное) вытесняют жиры, получаемые из рыбы, дичи и диких растений. Соотношение ПНЖК омега-6 к омега-3 в современном рационе повысилось от 1:1 до 10:1–20:1, что привело к негативным последствиям. Рост практически всех основных возрастных заболеваний специалисты напрямую связывают с дисбалансом ЖК в рационе.
Центральную роль в поддержке гомеостаза воспалительных реакций играют омега-3 ПНЖК – ЭПК и ДГК. ЭПК является предшественником тромбоксанов, простагландинов и лейкотриенов – высокоактивных иммуновоспалительных регуляторов.
Кроме того, недавно описаны окисленные метаболиты ЭПК и ДГК — резолвины, докозатриены и нейропротектины, обладающие противовоспалительными и защитными свойствами. Наш организм способен синтезировать ДГК и ЭПК из растительной короткоцепочечной альфа-линоленовой кислоты, однако этот процесс несовершенен и может блокироваться при чрезмерном употреблении омега-6 ПНЖК. До 25% ПНЖК головного мозга представлены ДГК, регулирующей процессы роста головного мозга плода в последнем триместре беременности [6]. ДГК составляет около 50% всех ЖК сетчатки и обеспечивает нормальное функционирование фоторецепторов, что определяет остроту зрения. Недостаточное поступление ДГК во время беременности приводит к ухудшению развития когнитивных функций и зрения [7,11]. Омега-3 ПНЖК обеспечивают иммунные функции в организме путем синтеза эйкозаноидов, контролируя интенсивность и длительность воспалительных реакций. Метаболиты ДГК снижают активность воспалительных и иммунных реакций, ингибируя ИЛ-6, ИЛ-8 и фактор некроза опухолей β, способствуя тем самым формированию пищевой толерантности.
Накопление ЭПК и ДГК в тканях наиболее эффективно, когда они поступают непосредственно с пищей или когда конкурирующие количества омега-6 аналогов являются низкими.
В современном мире реальным источником омега-3 ПНЖК является морская рыба (лосось, форель, макрель, сельдь, тунец), жир морских млекопитающих, морские водоросли, домашние куриные яйца, семена льна и льняное масло. Следует отметить, что наиболее полезна рыба в сыром и слабосоленом виде, поскольку при приготовлении блюд большинство омега-3 ПНЖК разрушаются. Льняное масло содержит альфа-линоленовую кислоту, которая разрушается при термической обработке, поэтому масло должно быть только холодного отжима и использоваться только для заправки блюд. Небольшое количество омега-3 ПНЖК содержат грецкие орехи, семена тыквы, соевое, рапсовое и оливковое масла, а также петрушка, укроп, кинза, портулак.
Недавние исследования продемонстрировали снижение частоты аллергических заболеваний у детей в первые четыре года жизни при обогащении рациона питания на протяжении грудного возраста рыбьим жиром [9,13]. Считается, что синтезируемые из ЭПК эйкозаноиды менее активны, чем синтезированные из омега-6 ПНЖК. Это означает, что употребление матерью во время беременности пищи, обогащенной ЭПК, будет способствовать формированию менее аллергенной иммунной системы плода [8]. Результаты нескольких рандомизированных контролируемых исследований показали, что употребление матерью 0,2–3,7 г ДГК и ЭПК в сутки снижает риск развития пищевой аллергии и экземы у ребенка, улучшает психическое развитие, визуально-двигательную координацию и остроту зрения [8,9,11,13]. Положительное влияние дополнительного приема омега-3 ПНЖК (0,3–0,6 г/сутки) отмечено у детей с синдромом дефицита внимания с гиперактивностью [12].
В США Комитетом пищевых продуктов и питания рекомендовано потребление омега-3 ПНЖК для детей дошкольного возраста 0,15 г/сутки, а ВОЗ — 0,1–0,25 г/сутки в зависимости от возраста [5].
Таким образом, с помощью современного пищевого рациона достаточно сложно получить необходимое количество омега-3 ПНЖК. Ситуация усугубляется широким использованием в пищевом производстве кулинарных жиров, маргаринов, растительных масел, трансжиров, содержащих много омега-6 ЖК, что на фоне сниженного употребления омега-3 ПНЖК усугубляет дисбаланс между квотой омега-6 и омега-3 ПНЖК.
Целью работы было изучение жирно-кислотного спектра липидной фракции крови у детей раннего возраста с пищевой аллергией и эффективности диетической коррекции его нарушений.
Материал и методы исследования
Обследовано 45 детей в возрасте от 6-ти месяцев до 3-х лет, которые находились на обследовании и лечении в отделении проблем питания и соматических заболеваний детей раннего возраста ГУ «ИПАГ НАМН Украины»: 25 больных пищевой аллергией (ПА) составили основную группу и 20 – контрольную. Средний возраст пациентов к моменту проведения исследования составил 1,3±0,2 года.
Критериями включения были ранний возраст и наличие гастроинтестинальных и кожных проявлений ПА. Диагноз устанавливали на основании данных аллергологического анамнеза, наличия гастроинтестинальных проявлений ПА (боли в животе, рвота, вздутие живота, диарея, запоры), аллергических проявлений со стороны других органов и систем (кожа, глаза, нос, легкие), наличия сенсибилизации к пищевым аллергенам, повышения уровня эозинофильного катионного белка в сыворотке крови и положительного клинического эффекта от элиминации «причинного» аллергена.
Количественное определение содержания жирных кислот в крови проводили методом капиллярной газовой хроматографии.
Экстракцию жирных кислот липидной фракции цельной венозной крови проводили методом Блайя – Дайера. Хроматографирование метиловых эфиров жирных кислот проводили на газовом хроматографе «Кристаллюкс-4000М» с пламенно-ионизационным детектором в определенных нами оптимальных условиях газохроматографического разделения и количественного определения. Разделение исследуемых веществ производилось на капиллярной колонке Zebron ZB-WAX с полиэтиленгликолем. Обработка хроматографической информации производилась с помощью программы Netchromwin. По результатам работы был определен состав и соотношение жирных кислот в липидной фракции цельной венозной крови детей основной и контрольной групп наблюдения.
Больные получали базовую терапию в соответствии с рекомендациями Руководства NIAID (The National Institute of Allergy and Infectious Diseases — Национальный институт аллергии и инфекционных заболеваний) по диагностике и лечению ПА в США – «Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID-Sponsored Expert Panel» (The Journal of Allergy and Clinical Immunology, Vol. 126, Issue 6, Suppl., Pages S1-S58, December 2010), которая включала: элиминационную диету, антигистаминные, ферментные препараты, антилейкотриеновые препараты и топические глюкокортикостероиды по показаниям [1,2].
Дети с ПА в составе комплексной терапии получали Смарт Омега® беби (SCHONEN, Швейцария—Великобритания) в течение месяца в дозе 5 мл (1 чайная ложка) 1 раз в день во время еды с последующим контролем эффективности коррекции путем определения жирно-кислотного спектра липидной фракции цельной крови в динамике на 30-й день приема диетической добавки. Клиническая эффективность применения Смарт Омега беби оценивалась по интенсивности клинических проявлений со стороны желудочно-кишечного тракта и кожи, динамике активности аллергического воспаления.
В качестве источника омега-3 ПНЖК был выбран Смарт Омега беби за счет удобной формы выпуска для детей раннего возраста. Смарт Омега® беби выпускается в виде масляного раствора во флаконах 100 мл и содержит в своем составе рыбий жир из тушек океанических рыб (омега-3 ПНЖК), 5 мл раствора содержат: витамин А – 400 мкг, витамин D3 – 5 мкг, витамин Е – 5 мг, экстракт плодов лимона. Энергетическая ценность на 100 мл составляет 3472 кДж/830 ккал. Смарт Омега® беби рекомендована для использования в рационе питания детей как дополнительный источник незаменимых омега-3 ПНЖК (ЭПК/ДГК) и жирорастворимых витаминов А, D3, Е с целью создания оптимальных диетологических условий функционирования когнитивной, нервной и костно-мышечной систем в период интенсивного роста и развития.
Результаты исследования и их обсуждение
Отягощенный семейный аллергологический анамнез отмечен у 2/3 детей с ПА: у 9 (36,0%) – по материнской линии, у 6 (24,0%) – по линии отца, у 5 (20,0%) – оба родителя имели аллергические заболевания.
Клинически пищевая аллергия у обследованных детей имела проявления со стороны желудочно-кишечного тракта и кожи. Чаще встречалось сочетание гастроинтестинального и кожного синдрома – у 44,0% детей; изолированные гастроинтестинальные проявления ПА отмечены у 16,0% пациентов.
Изолированный кожный синдром имелся у 20,0% детей.
Поражение кожи характеризовалось хроническим рецидивирующим течением с преобладанием эритематозно-сквамозных среднетяжелых форм (сухость, шелушение, эритема, экскориации). Средний показатель индекса SCORAD – 30 баллов.
Гастроинтестинальные проявления ПА характеризовались абдоминальным болевым, диспепсическим и дискинетическим синдромами.
В начале лечения болевой абдоминальный синдром отмечался у 60% детей. Частота регистрации диспепсического и дискинетического синдромов составляла 68,0% и 60% соответственно.
У всех обследованных обнаружена сенсибилизация к пищевым аллергенам: у 2/3 – к белкам коровьего молока, у 8 – к яичному белку, у 11 обнаружена сенсибилизация к аллергену пшеничной муки. Сенсибилизацию к двум и более пищевым аллергенам имели семеро обследованных.
Уровень общего IgE сыворотки свыше 2–3 норм выявлен только у девяти обследованных, среднее значение общего IgE составило 68,6 IU/ml при референтных значениях (<45 IU/ml). Эозинофильный катионный белок (ЭКБ) сыворотки крови был повышен у большинства обследованных, средний его показатель составил 78,5 нг/мл (при норме 0–24 нг/мл). Анализ параклинических данных детей с ПА показал изменения со стороны красной крови в виде гипохромной анемии и незначительной эозинофилии у 56,0% обследованных.
При исследовании жирно-кислотного спектра крови детей с ПА обращает внимание тенденция к увеличению содержания насыщенных (НЖК) и уменьшению ненасыщенных жирных кислот (НеНЖК) (табл.). Соотношение НеНЖК/НЖК у детей с ПА – 0,78, у пациентов контрольной группы наблюдения – 1,07. Соотношение НЖК/ПНЖК у детей с ПА – 2,17, в контрольной группе – 1,62. Физиологическое действие этих кислот в организме в значительной степени противоположно.
Ненасыщенные жирные кислоты принимают участие в построении клеточных и субклеточных мембран, уменьшают их текучесть и повышают вязкость, что сопровождается умеренной склонностью к перекисному окислению и повышением свертывания крови.
Ненасыщенные жирные кислоты снижают вязкость и повышают текучесть мембран, снижают свертываемость и содержание холестерина в крови. Выявленные изменения насыщенности ЖК, обычно происходящие при активации процессов липидной пероксидации, сопровождаются уменьшением ПНЖК. Насыщенные и ненасыщенные ЖК плазмы необходимы мембранам клеток для нормального функционирования и используются не только для поддержания их структуры, но и в качестве предшественников синтеза биологически активных соединений. Полученные данные показывают возможность использования длинноцепочечных жирных кислот для коррекции структуры и вязкости мембран клеток.
Параллельно с уменьшением концентрации НеНЖК снижается концентрация ПНЖК, причем в структуре ПНЖК увеличивается доля омега-6 фракции и ее основного представителя — АК. Имеется тенденция к увеличению уровня предшественника омега-6 ПНЖК — линолевой кислоты. При анализе уровня АК привлекает внимание тенденция к повышению ее концентрации у пациентов основной группы по сравнению со здоровыми детьми. Выявленные изменения в концентрации омега-6 ПНЖК – линолевой (ЛК) и ее производной – АК, по данным литературы, определяют провоспалительную направленность липидного спектра сыворотки крови. Учитывая, что на уровень указанных кислот влияет как наличие в рационе растительных масел и животных жиров, так и синтез АК из ЛК, который в значительной степени зависит от содержания омега-3 ПНЖК в организме, мы определяли соотношение АК и ЛК [3].
У детей контрольной группы коэффициент К составил 0,24, а у детей основной группы – 0,26.
При анализе уровня омега-3 ПНЖК в опытных группах выявлено, что их концентрация у детей раннего возраста с ПА практически не отличается от спектра здоровых детей.
Анализ полученных результатов хроматографического исследования выявил низкий уровень омега-3 ПНЖК и высокие концентрации омега-6 ПНЖК у пациентов обеих групп наблюдения. Соотношение в контрольной группе составляло 1:14 (что не является оптимальным согласно рекомендациям ВОЗ), а в группе детей с ПА — 1:19 (рис.).
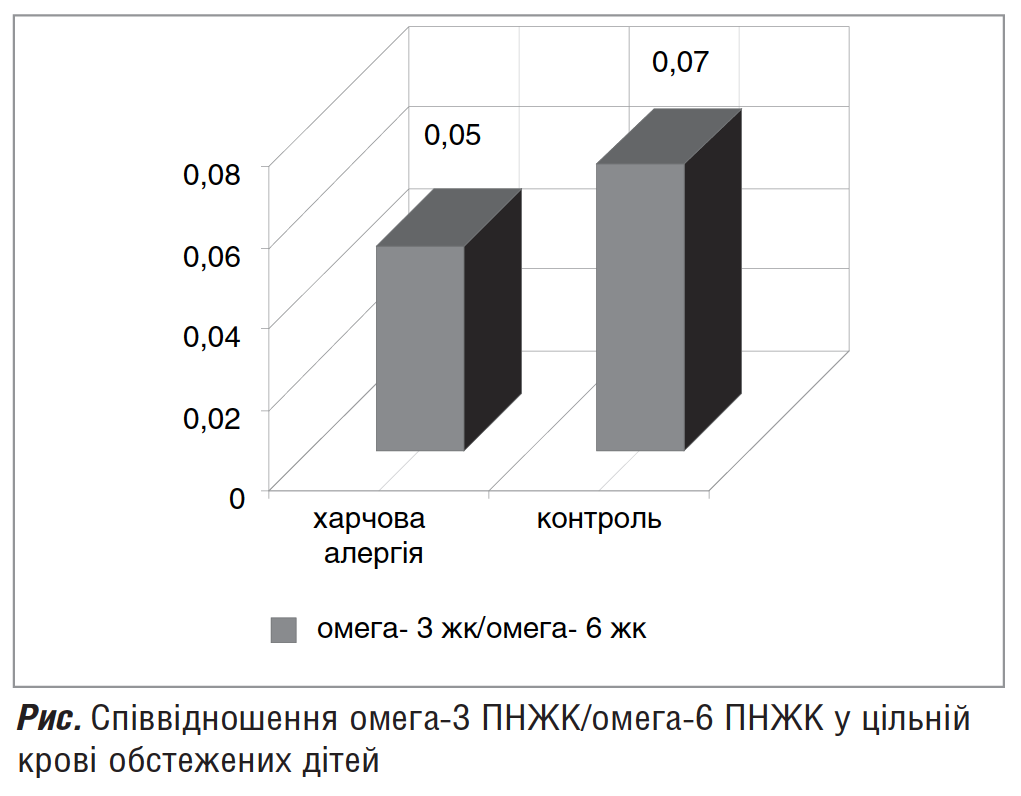
Таким образом, выявленный дисбаланс ЖК в сыворотке крови детей раннего возраста с ПА за счет увеличения доли омега-6 ПНЖК свидетельствует о провоспалительной направленности обмена липидов.
Учитывая описанную выше роль соотношения омега-3 ПНЖК/омега-6 ПНЖК в патогенезе ПА, мы провели коррекцию жирно-кислотного спектра у детей с ПА путем назначения им Смарт Омега® беби в составе комплексной терапии.
После месячного курса комплексной терапии с включением Смарт Омега® беби у пациентов основной группы наблюдения произошло уменьшение расстройств со стороны желудочно-кишечного тракта – уменьшение частоты дискинетического (с 68,0% до 16,0%) и диспепсического синдрома (с 60,0% до 20,0%) и улучшение состояния кожи – достоверное снижение среднего балла по шкале SCORAD с 32 баллов в начале лечения до 10 баллов соответственно. Отмечено достоверное снижение концентрации ЭКБ в сыворотке крови как показателя активности аллергического воспаления практически до нормальных значений (28,6±1,5 против 78,5±2,8 нг/мл).
Коррекция жирно-кислотного спектра липидной фракции крови детей раннего возраста с ПА с помощью Смарт Омега® беби способствовала положительным изменениям липидного спектра крови: достоверно увеличилась концентрация омега-3 ПНЖК (с 1,45% до 2,9%) и снизился уровень омега-6 ПНЖК (с 28,45% до 20,12%), что привело к достоверному снижению соотношения омега-3/омега-6 ПНЖК – 1:7 по сравнению с 1:19 в начале коррекции.
С целью достижения более выраженного влияния на соотношение омега-3/омега-6 ПНЖК, вероятно, необходим более длительный курс приема диетической добавки, содержащей в своем составе омега-3 ПНЖК.
Индивидуальная переносимость Смарт Омега была хорошей у всех 25 детей основной группы. В процессе выполнения исследования не наблюдалось отрицательных реакций на прием диетической добавки, в том числе не выявлено аллергических реакций или усиления клинической симптоматики заболевания у детей с ПА.
Выводы
- По результатам анализа жирно-кислотного спектра липидной фракции цельной крови детей раннего возраста с ПА установлен дисбаланс жирных кислот за счет увеличения доли омега-6 ПНЖК, что свидетельствует о провоспалительной направленности обмена липидов.
- Включение в состав комплексной терапии детей раннего возраста с ПА Смарт Омега® беби с целью коррекции жирно-кислотного спектра крови привело к положительным изменениям соотношения омега-3/омега-6 ПНЖК.
- Учитывая выявленные нарушения соотношения омега-3/омега-6 ПНЖК у практически здоровых детей, рекомендовано назначение с профилактической целью детям раннего возраста омега-3 ПНЖК.
ЛИТЕРАТУРА
1.Клыкова Т. В. Пищевая аллергия у детей раннего возраста: подходы к диагностике и лечению / Т. В. Клыкова, Е. В. Агафонова, И. Д. Решетникова // Практич. медицина. — 2011. — № 51. — С. 125—131.
2.Осообливості діагностики та підходи до лікувально-профілактичного харчування дітей раннього віку з алергією до білка коров’ячого молока: методичні рекомендації / Шадрін О.Г., Няньковський С.Л., Добрянський Д.О. [та ін.]. — Київ, 2014. — 28 с.
3.Сороколєтова А. Б. Клініко-патогенетичне обгрунтування застосування омега-3 поліненасичених жирних кислот при затяжному перебігу діареї у дітей раннього віку: дис. … канд. мед. наук : 14.01.10 / А. Б. Сороколєтова. — Київ, 2008. — 152 с.
4.Шадрин О. Г. Нарушения жирнокислотного спектра крови и пути его коррекции у детей с врожденными гепатитами / О. Г. Шадрин, Н. Ф. Чернега, Р. В. Марушко // Современная педиатрия. — 2014. — № 8 (64). — С. 98—103.
5.Обзор образа питания и качества потребляемой пищи / Nelson M. [и др.]. — Т. 2 : Объем потребляемой пищи и питательных веществ. — Головной офис: Лондон, 2007.
6.Рост и развитие недоношенных детей, вскармливаемых смесями с содержанием длинноцепочечных полиненасыщенных жирных кислот: проспективное, рандомизированное контролируемое исследование / O’Connor D. L. [et al.] // Pediatrics. — 2001. — Vol. 108. — P. 359—371.
7.Незаменимые n-3 жирные кислоты в питании беременных женщин и ранее созревание органов зрения у доношенных детей / Innis S. M. [и др.] // Американский журнал клинического питания. — 2008. — № 87. — С. 548—557.
8.Пищевые добавки с рыбьим жиром во время беременности регулируют аллергические реакции у младенцев и определяют клинический исход у детей с высоким риском атопических реакций: рандомизированное контролируемое исследование / Dunstan J. [et al.] // Journal of Allergy and Clinical Immunology. — 2003. — Vol. 112. — P. 1178—1184.
9.Пищевые добавки с рыбьим жиром при беременности и лактации могут снизить риск развития аллергии у детей / Furuhjelm C. [et al.] // Acta Paediatrica. — 2009. — Vol. 98. — P. 1461—1467.
10.Оценка когнитивной функции детей в возрасте 2(1/2) лет после того, как их матери во время беременности употребляли пищевые добавки с рыбьим жиром: рандомизированное контролируемое исследование / Dunstan J. A. с соавт. // Archives of Disease in Childho-od Fetal Neonatal Edition. — 2008. — Vol. 93. — P. 45—50.
- Питание во время беременности с докозагексаеновой кислотой оказывает положительное воздействие на развитие зрения младенцев в возрасте 4 месяцев / Judge M. P. [et al.] // Lipids. — 2007. — Vol. 42. — P. 117—122.
- Двойное слепое, плацебо контролируемое исследование действия пищевых добавок с омега-3 ЖК на детей в возрасте 8—10 лет / Kirby A. [et al.] // Research in Developmental Disabilities. — 2010. — Vol. 31. — P. 718—730.
- W orld Association of Perinatal Medicine Dietary Guidelines Working Group.The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations / Koletzko B., Lien E., Agostoni C. [et al.] // J. Perinat.
Med. — 2008. — Vol. 36 (1). — P. 5—14.
Жирно-кислотный спектр крови и пути коррекции его нарушений у детей раннего возраста с пищевой аллергией
О.Г. Шадрин, Г.А. Гайдучик
ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины», г. Киев, Украина
Цель: исследование жирнокислотного спектра липидной фракции крови у детей раннего возраста с пищевой аллергией (ПА) и эффективности диетической коррекции его нарушений.
Пациенты и методы. Обследовано 45 детей в возрасте от 6-ти месяцев до 3-х лет. Всем детям проводилось исследование жирнокислотного спектра липидной фракции крови. Дети с ПА (25 чел) в составе комплексной терапии получали Смарт Омега® беби в течение месяца.
Результаты. По результатам анализа жирнокислотного спектра липидной фракции цельной крови у детей с ПА установлен дисбаланс жирных кислот за счет увеличения доли омега-6 ПНЖК, что свидетельствует о провоспалительной направленности обмена липидов. Включение в состав комплексной терапии ПА Смарт Омега® беби привело к положительным изменениям соотношения омега-3/омега-6 ПНЖК. У пациентов основной группы наблюдения произошло уменьшение расстройств со стороны желудочнокишечного тракта, улучшение состояния кожи.
Выводы. Учитывая выявленные нарушения соотношения омега-3/омега-6 ПНЖК как у детей с ПА, так и у практически здоровых обоснован приём омега3 ПНЖК.
Ключевые слова: пищевая аллергия, полиненасыщенные жирные кислоты, дети раннего возраста.
The ways of correction of fatty-acid profile of the blood in infants with food allergies
O.G. Shadrin, G.A. Gayduchik
SI «Institute of Pediatrics, Obstetrics and Gynecology NAMS of Ukraine», Kiev, Ukraine
Objective: Examination of the fatty-acid profile of the lipid fraction of blood in infants with food allergy (FA) and the effectiveness of dietary correction of violations.
Patients and methods. The study involved 45 children in the age from 6 months to 3 years. All children underwent examination of the fatty-acid profile of the lipid blood fractions. A total of 25 children with FA in the complex therapy had received a dietary supplement «Smart omega® baby lemon» within a month.
Results. According to the results of analysis of the fatty-acid profile of the lipid blood fraction in children with FA was found a fatty acids imbalance due to the increasing of the proportion of omega-6 PUFA, which is certifies about the proinflammatory direction of lipid metabolism. The inclusion to the complex therapy FA dietary supplement «Smart omega® baby lemon» has led to positive changes in the ratio of omega-3 / omega-6 PUFAs. In patients of the main group of observation was marked a reduction of disorders of the gastrointestinal tract and skin improvement.
Conclusions. For infants was recommended application of preparations containing omega-3 PUFAs taking into account the identified violations of the ratio of omega-3 / omega-6 PUFA as in children with FA so in practically healthy.
Key words: food allergy, polyunsaturated fatty acids, infants.




